VOLUME MOLAR
PARSIAL
Sifat molar parsial yang paling mudah digambarkan adalah volume “molar parsial” yaitu kontribusi dari suatu komponen dalam sampel
terhadap volume total
pada volume.
Apabila dimisalkan suatu volume
yang besar dari air murni, kemudian ditambahkan 1 mol H2O, maka
volumenya bertambah 18 cm3 dan kita dapat mengatakan bahwa 18 cm3
/mol merupakan volume molar air murni. Meskipun demikian jika kita menambahkan
1 mol H2O kedalam etanol murni yang volumenya besar, maka pertambahan volumenya
hanya 14 cm3, alasan dari perbedaan kenaikan volume ini adalah volume yang
ditempati oleh sejumlah tertentu molekul air bergantung pada molekul-molekul
yang mengelilinginya. Begitu banyak etanol yang
ada sehingga setiap molekul H2O dikelilingi oleh etanol murni
kumpulan molekul-molekul itu menyebabkan etanol hanya menempati ruang sebesar
14 cm3.kuantitas 14 cm3 mol -1 adalah volume molar parsial air dalam etanol murni yaitu volume
campuran yang dapat dianggap berasal dari satu komponen.
Volume molar parsial komponen suatu campuran berubah-ubah bergantung
pada komposisi karena lingkungan setiap jenis molekul berubah Jika komposisi
nya berubah dari zat A murni ke zat B murni .perubahan lingkungan inilah yang menghasilkan variasi sifat
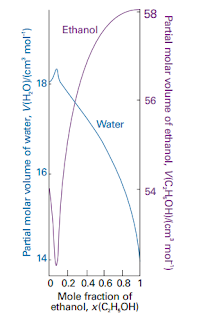
termodinamika campuran jika komposisinya berubah. Volume molar parsial air dan
etanol sepanjang rentang komposisi penuh pada temperatur 25 derajat Celcius
diperhatikan pada gambar 1.1
Gambar 1.1 Volume molar parsial air dan etanol pada temperatur 250C.perbedaan
skala (air sebelah kiri dan etanol sebelah kanan).
Volume molar parsial Vj dari suatu zat J pada beberapa komposisi umum didefinisikan secara formal sebagai :
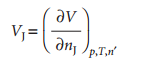 1)
1)
 2)
2)
Alasan yang
melatarbelakangi hasil yang sederhana ini adalah sebagai berikut. Apabila suatu
sampel yang sangat besar dari campuran yang komposisinya tertentu kemudian jika
sejumlah nA zat A ditambahkan, komposisinya tetap tidak berubah VA tetap, dan volume sampel berubah sebesar nA VA. Jika nB zat zat B ditambahkan
volume berubah sebesar nB VB dengan alasan yang sama pula. Oleh karena itu
perubahan volume total adalah nA
VA. + nB VB. Sekarang sampel
menempati volume yang lebih besar, namun perbandingan komponen-komponennya tetap sama. Selanjutnya, apabila
diambil dari volume yang besar ini, sampel yang terdiri dari nA zat A dan nB zat B volumenya
adalah nA VA. + nB VB. Karena V termasuk fungsi , sampel yang sama dapat
disiapkan hanya dengan mencampurkan jumlah yang tepat dari zat A dan zat B ini
sesuai dengan persamaan 3.
Contoh
soal:
Seorang
pelayan bar mencoba membuat 100 cm3 minuman dengan mencampurkan 30
cm3 etanol dan 70 cm3 air pada temperatur 25 derajat
Celcius Berapa volume yang harus dicampurkan agar mencapai volume yang diperlukan.
Jawab:
Berdasarkan
paparan soal di atas nampaknya pelayan baru tersebut tidak mengetahui konsep
pentingnya kuantitas molar parsial. Untuk mendapatkan
volume molar campuran tersebut kita harus menggunakan persamaan 3. Dan
mengambil volume molar parsial dari gambar 1.1 untuk komposisi tertentu.
Komposisi fraksi mol campuran ditentukan dengan rapatan dan massa molar
komponen. Jumlah yang sesuai dengan volume yang dimaksud adalah 3,87 mol H2O
dan 0,514 mol etanol atau C2 H5OH. Oleh karena itu H2O = 0,883 dan X C2H5OH = 0,117. Dari
gambar 1.1 volume molar parsial pada komposisi ini adalah H2O = 18 cm3 /mol
dan V C2 H5 OH = 53,6 cm3
/mol dan volume total campuran adalah V = (3,870 X 18,0 cm3 /mol)
+ (0,5140 X 53,6 cm3/mol) = 97,3 cm3
Berdasarkan penjabaran perhitungan di atas
campuran yang komposisinya relatif sama namun dengan volume total 100 cm titik
akan mempunyai fraksi mol yang sama dari komponen-komponennya Oleh karena itu
volume molar parsialnya sama tetapi jumlah keseluruhan berbeda jadi kita harus
menyesuaikan volume yang dicampur dengan perbandingan 100/97,3 = 1,028 Oleh karena itu campuran yang sesuai
adalah 72 cm3 air dan 30,8cm3 etanol
Volume = (1,028 X 70) + (1,028 X 30) =
102,02
M.Abdul Chalim
(15630048)
dafatar pustaka
Atkins, P.W. 1990. Kimia Fisika Jilid 1 Edisi Keempat. Penerbit Erlangga. Jakarta.
dafatar pustaka
Atkins, P.W. 1990. Kimia Fisika Jilid 1 Edisi Keempat. Penerbit Erlangga. Jakarta.

Tidak ada komentar:
Posting Komentar