PENURUNAN TITIK BEKU LARUTAN
Larutan membeku pada suhu yang lebih rendah
dari pelarut murni. Fenomena ini disebut sebagai penurunan titik beku.
Penurunan titik beku larutan merupakan sifat koligatif larutan yang tergantung
pada sejumlah partikel terlarut dalam larutan. Semakin tinggi konsentrasi
larutan, semakin besar pula penurunan titk bekunya (Atkins, 1994).
Adapun
pengertian dari titik beku suatu cairan adalah suhu dimana tekanan uap cairan
sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah daripada
titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku
terlebih dahulu, baru zat terlarutnya. Adanya zat terlarut mengakibatkan suatu
pelarut semakin sulit membeku, akibatnya titik beku larutan akan lebih rendah
dibandingkan dengan titik beku pelarut murninya. Selisih antara titik beku
pelarut dengan titik beku larutannya disebut penurunan titik beku larutan (Atkins, 1994).
∆Tf = Tf pelarut
- Tf larutan
Penurunan
titik beku tidak bergantung kepada jenis zat terlarut, tetapi hanya bergantung
pada konsentrasi larutan. Untuk larutan encer, penurunan titik beku sebanding
dengan kemolalan larutan (Atkins, 1994)
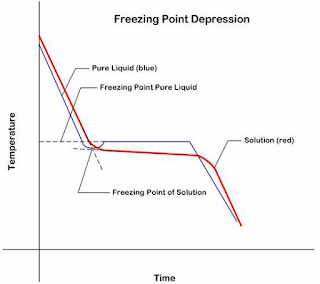
Gambar 1. Alur titik beku pelarut murni dan larutan
Proses pembekuan suatu
zat cair terjadi bila suhu diturunkan, sehingga jarak antarpartikel sedemikian
dekat satu sama lain dan akhirnya bekerja gaya tarik menarik antarmolekul yang
sangat kuat. Adanya partikel-partikel dari zat terlarut akan mengakibatkan
proses pergerakan molekul-molekul pelarut terhalang, akibatnya untuk dapat
lebih mendekatkan jarak antarmolekul diperlukan suhu yang lebih rendah. Jadi
titik beku larutan akan lebih rendah daripada titik beku pelarut murninya.
Perbedaan titik beku akibat adanya partikel-partikel zat terlarut disebut
penurunan titik beku (∆Tf) (Chang, 2003).
Titik beku pelarut murni adalah konstant, tapi
titik beku larutan perlahan menurun. Penurunan ini disebabkan oleh peningkatan
konsentrasi zat terlarut. Zat terlarut dapat berupa zat non-elektrolit dan
elektrolit (Chang, 1994).
DTf
= kf . m (non- elektrolit)
DTf
= kf . m . i (elektrolit)
DTf
= Tf pelarut – Tf larutan
Konstanta penurunan titik beku molal
(ebulioskopi), Kf dapat ditentukan dengan menggunakan Persamaan :
Sedangkan
massa molekul relatif dari zat terlarut dapat ditentukan dengan menggunakan
persamaan :
dengan
Ga = massa
pelarut
Gb = massa
zat Terlarut
m =
molalitas
Ma = berat
molekut pelarut
Mb = berat
molekul zat terlarut
DT = perubahan titik beku
I = faktor Van’t Hoff
Daftar Pustaka
Atkins, P. W. 1994. Kimia Fisika. Jakarta : Erlangga
Chang, Raymond. 2003. Kimia Dasar. Jakarta : Erlangga
Ditulis oleh : SILVIA ABDI PRATAMA (15630067)
Tidak ada komentar:
Posting Komentar